2025年10月30日,程金波教授在阿尔茨海默病致病机制方面取得重要进展,研究成果以“Microglial Rack1 Deficiency Alleviates Alzheimer’s Disease Pathology through Enhancing IGF1-Mediated Astrocytic Phagocytosis”为题发表在国际顶级期刊Advanced Science(中国科学院1区Top,五年影响因子IF=15.6)。
阿尔茨海默病(Alzheimer’s Disease,AD)是最主要的神经退行性疾病,以进行性认知功能障碍和行为损害为特征,发病机制尚未阐明,临床缺少有效的治疗手段。胶质细胞激活和神经炎症是AD的重要特征,也是疾病发生发展的重要原因,然而胶质细胞激活之间的分子通讯以及神经炎症在疾病过程中的发生机制并不清楚。研究首次明确了支架蛋白Rack1在小胶质细胞功能调控以及AD病理进程中的重要作用,揭示了AD病理条件下小胶质细胞与星形胶质细胞互作的分子机制,为靶向神经炎症治疗AD提供了重要靶点和潜在的干预策略。论文链接:https://advanced.onlinelibrary.wiley.com/doi/10.1002/advs.202515877。

小胶质细胞是中枢神经系统中主要的免疫细胞,在AD的病理生理中起着关键作用。课题组前期开展的一系列研究已发现小胶质细胞在神经炎症发生和神经系统疾病中发挥重要作用,相关成果分别发表于Science Advances(2021, IF=14.9)、Theranostics(2023,IF=12.4)、Autophagy(2020, IF=16.0)、Cell Death and Differentiation(2017, IF=15.8)、Journal of Neuroinflammation(2020, 2021, IF=9.5)等优秀期刊。
Rack1是一种细胞内多功能支架蛋白,可以介导多条胞内信号转导,调控细胞增殖、凋亡等过程,但是否参与小胶质细胞功能调控和AD病理进程并不清楚。本研究发现AD模型小鼠和AD患者的小胶质细胞中Rack1水平升高,为了进一步研究Rack1在小胶质细胞中的功能,构建了小胶质细胞Rack1条件性敲除小鼠。研究发现在5×FAD模型小鼠背景下,小胶质细胞Rack1的条件性敲除显著减轻了认知障碍和减少了Aβ的沉积(图1和图2)。
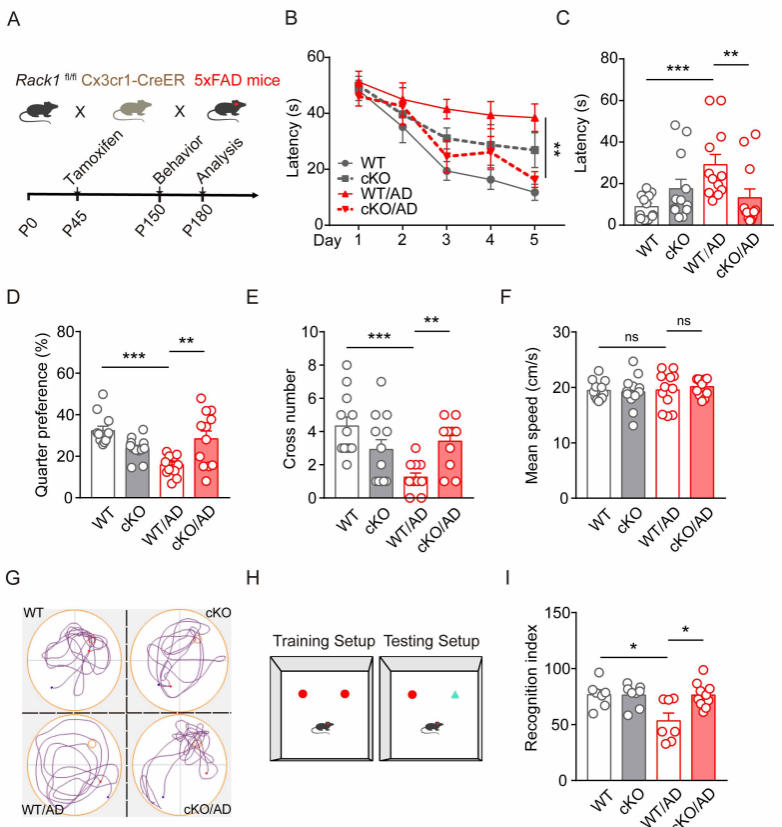
图1:敲除小胶质细胞Rack1改善AD模型小鼠的认知损伤
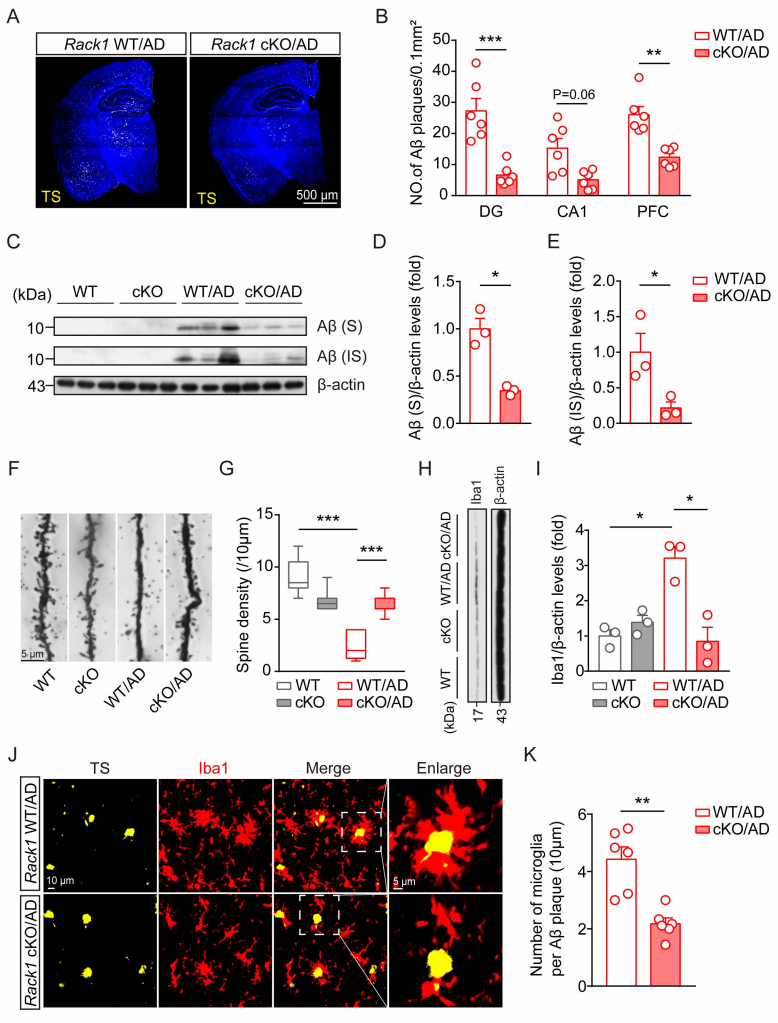
图2:敲除小胶质细胞Rack1改善AD模型小鼠的病理损伤
进一步研究发现小胶质细胞Rack1缺失减少了小鼠脑内小胶质细胞的数量,抑制了小胶质细胞对于Aβ的包裹和吞噬能力,但同时增加了星形胶质细胞的增殖和吞噬作用(图3),提示可能通过星形胶质细胞的激活来发挥保护作用。
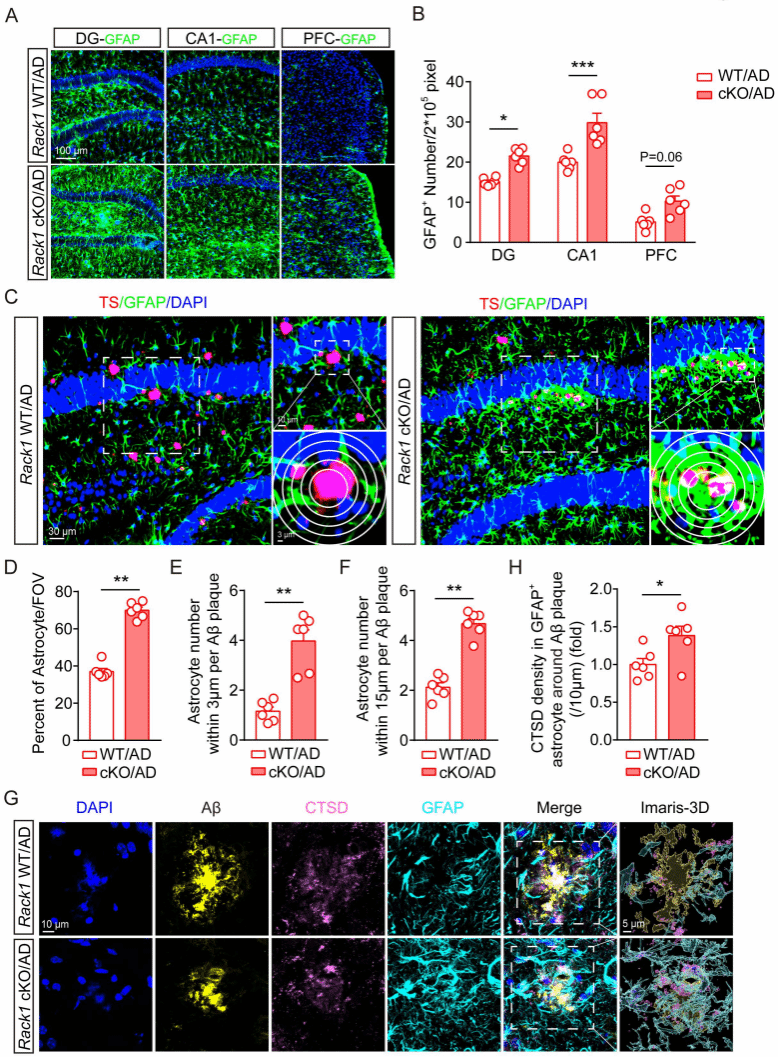
图3:敲除小胶质细胞Rack1增加星形胶质细胞的吞噬能力
通过一系列机制方面的实验研究,发现小胶质细胞Rack1缺失上调了IGF1的水平,同时Rack1缺失所引起的保护作用是通过小胶质细胞和星形胶质细胞之间的IGF1-IGF1R信号介导的。通过在体给予小鼠IGF1R的小分子抑制剂可以显著抑制星形胶质细胞的激活,以及消除小胶质细胞缺失Rack1引起的神经保护效应(图4-图6)。
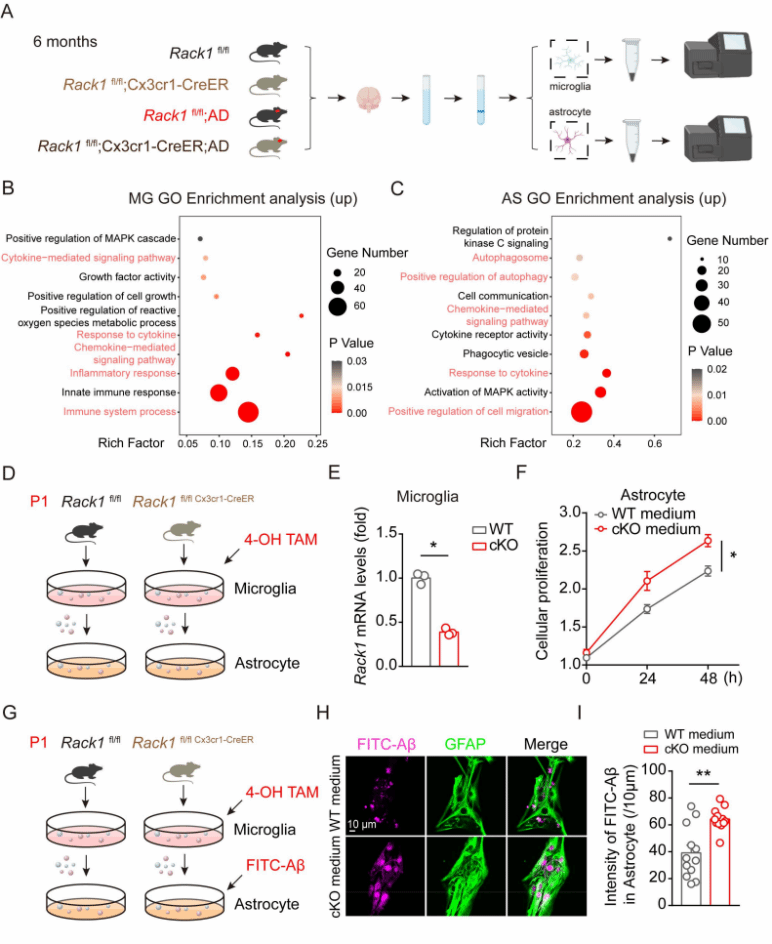
图4:星形胶质细胞吞噬能力的增加是由小胶质细胞所介导
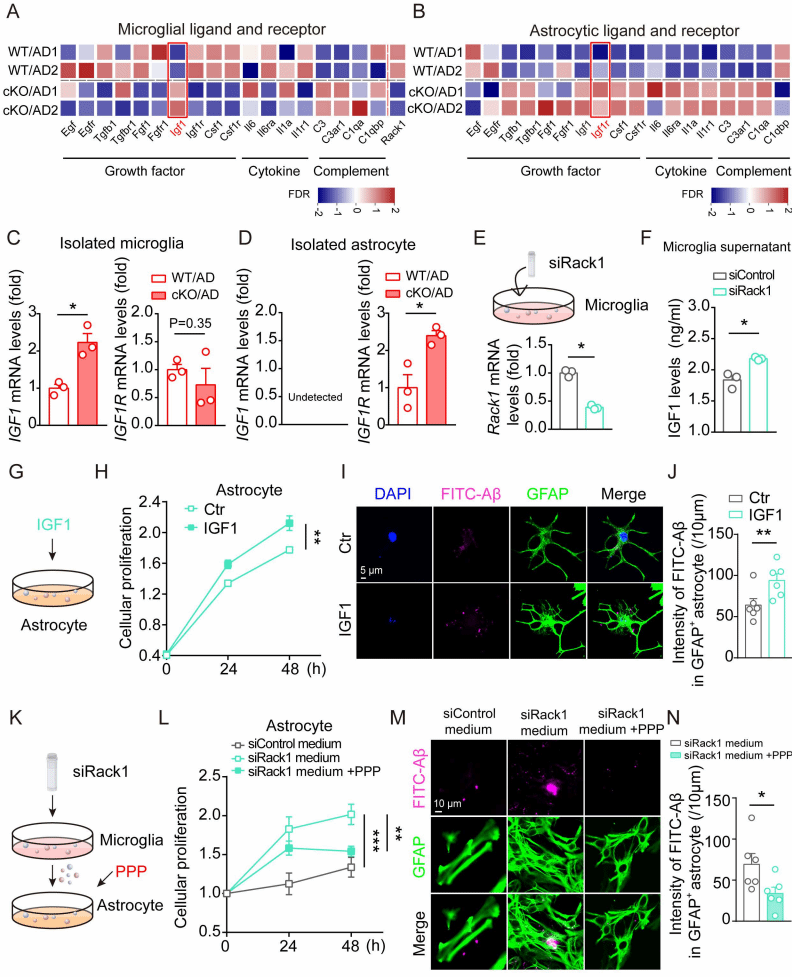
图5:IGF1参与小胶质细胞对星形胶质细胞吞噬能力的调控
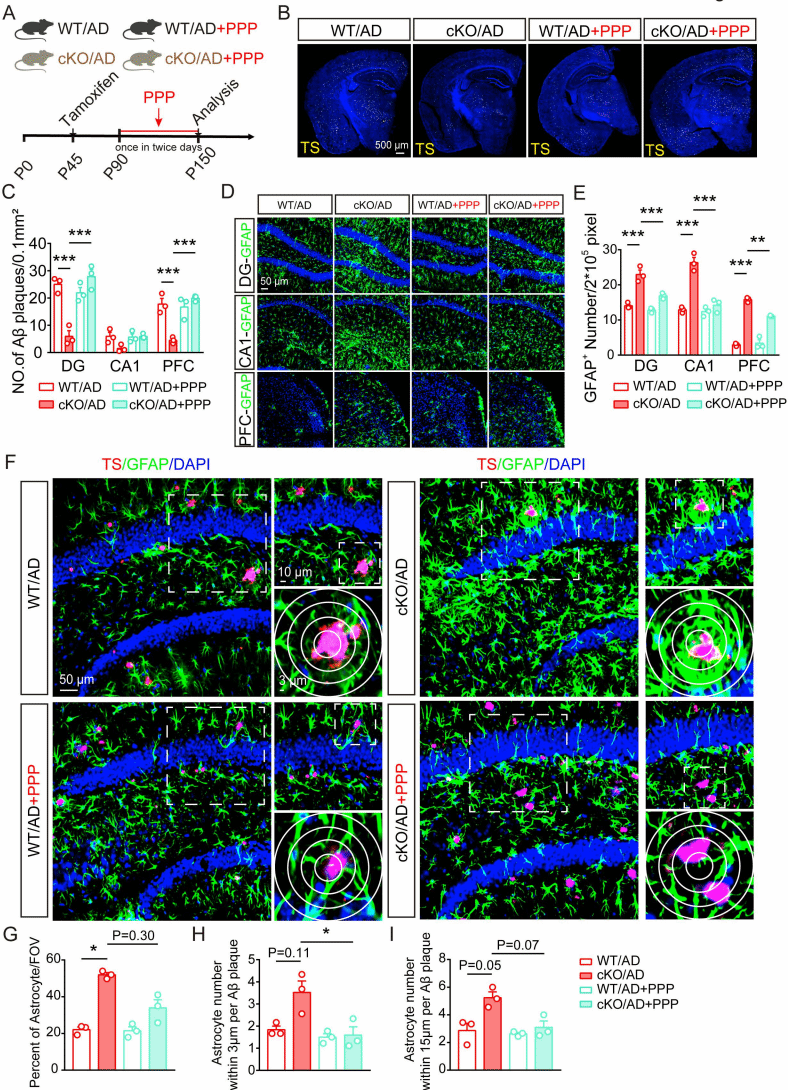
图6:IGF1-IGF1R信号介导小胶质细胞与星形胶质细胞的互作
本研究发现了小胶质细胞Rack1缺失通过增强IGF1介导的星形胶质细胞吞噬作用,减少了AD模型小鼠中Aβ沉积和神经炎症,改善了AD模型小鼠的认知障碍,为小胶质细胞-星形胶质细胞互作提供了新见解,也为AD的治疗提供了新的干预靶点和新策略(图7)。
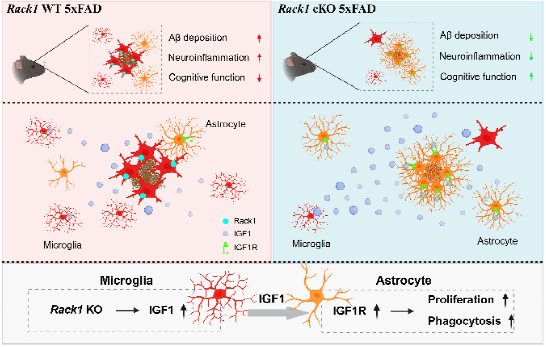
图7:小胶质细胞Rack1缺失改善AD的分子机制示意图
学院硕士研究生张竞丹为论文共同第一作者,程金波教授为论文共同通讯作者。中央民族大学作为第一通讯单位,本项工作得到国家自然科学基金、教育部重点实验室项目基金、以及中央民族大学创新团队基金等项目的联合资助。
(供稿:程金波 审校:孟月娟、陈坦、张严)

